乙酰乙酸乙酯合成
本文最后更新于:2020年5月23日 晚上
文献和图片来源:Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press。
本文仅供学习交流,如有侵权,请联系作者删除。
本文首发于B站专栏文章乙酰乙酸乙酯合成法。
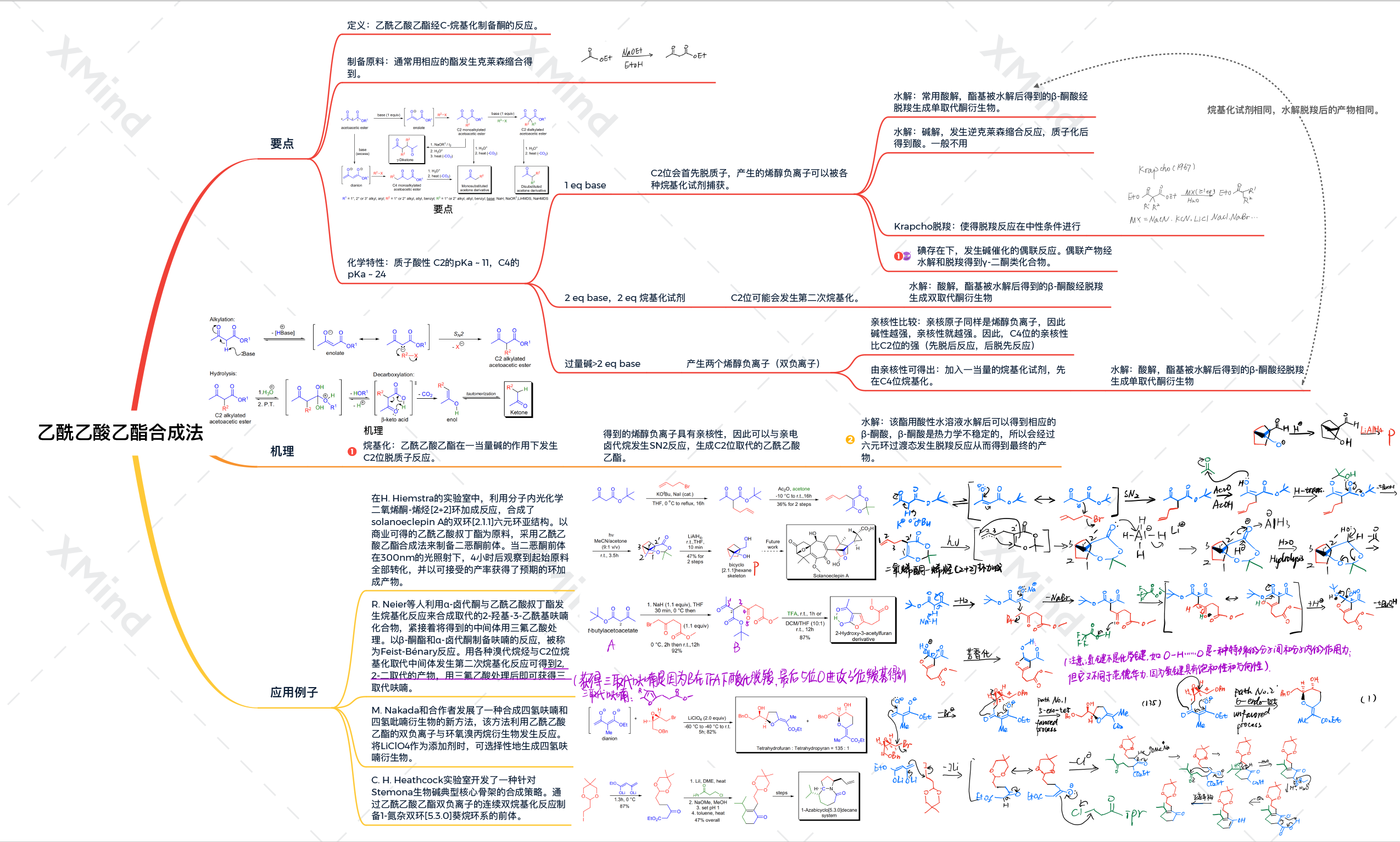
要点
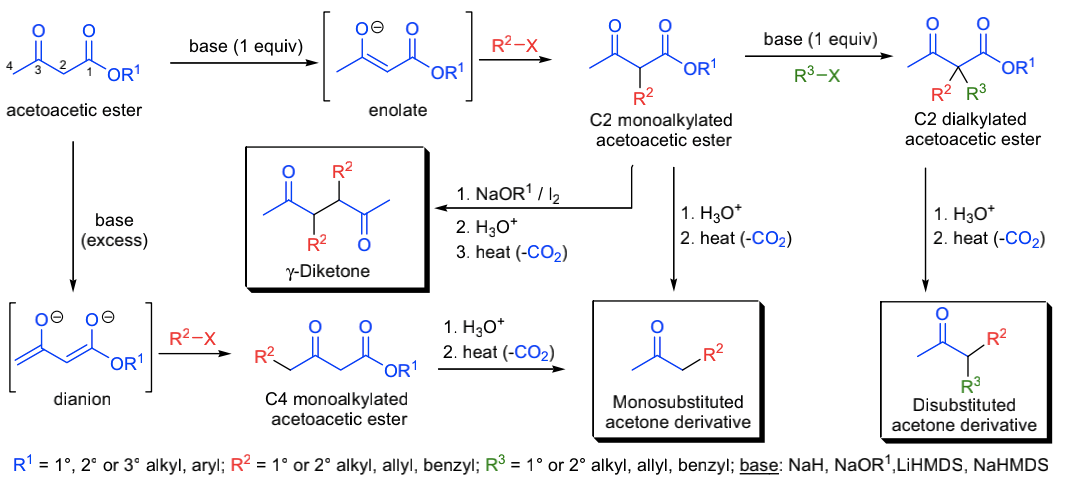
3-氧丁酸酯(乙酰乙酸乙酯)经C-烷基化反应制备酮的方法称为乙酰乙酸乙酯合成法。乙酰乙酸乙酯根据碱的用量可以在C2位脱质子或在C2/C4位同时脱质子。C2位碳原子上的C-H键在邻位两个羰基的吸电子作用下被活化。C2/C4位氢原子显酸性(C2的pKa ~ 11,C4的pKa ~ 24),所以在一当量碱(氢氧化钠,LDA,NaHMDS或LiHMDS等等)存在下,C2位首先脱质子。产生的烯醇负离子可以被各种烷基化试剂捕获。在额外一当量碱和烷基化试剂的存在下,C2位可能发生第二次烷基化。当乙酰乙酸乙酯用过量的碱处理时,会产生相应的双负离子(又产生了一个烯醇负离子)。当亲电试剂(如:卤代烷)加入到双负离子中,烷基化首先会发生在亲核性最强(反应性最强)的C4位。得到的烷基化乙酰乙酸乙酯衍生物可以用两种方式水解,这取决于具体的反应条件:
- 稀酸水解酯基,得到的β-酮酸经脱羧生成酮(单取代或双取代丙酮衍生物);
- 在碱的水溶液中,发生逆克莱森反应,在质子化后得到酸。
稀酸水解是最常用的水解方法,因为反应混合物不会被酮类副产物污染。最近使用的Krapcho脱羧使得反应可以在中性条件下进行。与丙二酸酯一样,乙酰乙酸乙酯的单烷基衍生物在碘的存在下会发生碱催化的偶联反应,偶联产物经水解和脱羧得到γ-二酮类化合物。乙酰乙酸乙酯通常是通过相应的酯发生克莱森缩合反应获得,但也可以用其他的方法来制备它们。
机理
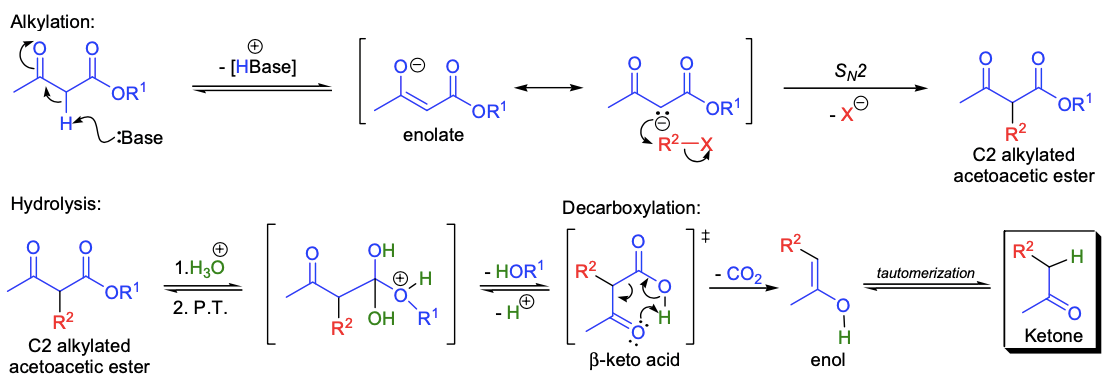
第一步是乙酰乙酸乙酯在一当量碱的作用下发生C2位脱质子反应。得到的烯醇负离子具有亲核性,因此可以与亲电卤代烷发生SN2反应,生成C2位取代的乙酰乙酸乙酯,该产物可以被分离出来。酯用酸性水溶液水解后可以得到相应的β-酮酸,β-酮酸是热力学不稳定的,所以会经过六元环过渡态发生脱羧反应从而得到最终的产物。
合成应用
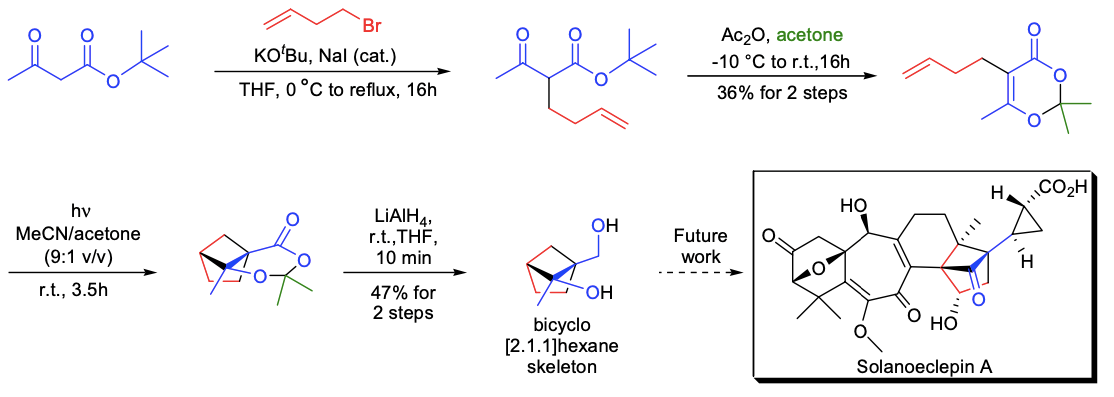
在H. Hiemstra的实验室中,利用分子内光化学二氧烯酮-烯烃[2+2]环加成反应,合成了solanoeclepin A的双环[2.1.1]六元环亚结构。以商业可得的乙酰乙酸叔丁酯为原料,采用乙酰乙酸乙酯合成法来制备二恶酮前体。当二恶酮前体在300nm的光照射下,4小时后观察到起始原料全部转化,并以可接受的产率获得了预期的环加成产物。
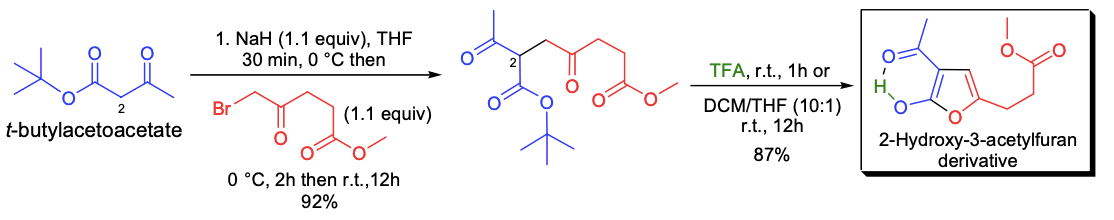
R. Neier等人利用α-卤代酮与乙酰乙酸叔丁酯发生烷基化反应来合成取代的2-羟基-3-乙酰基呋喃化合物,紧接着将得到的中间体用三氟乙酸处理。以β-酮酯和α-卤代酮制备呋喃的反应,被称为Feist-Bénary反应。用各种溴代烷烃与C2位烷基化取代中间体发生第二次烷基化反应可得到2,2-二取代的产物,用三氟乙酸处理后即可获得三取代呋喃。
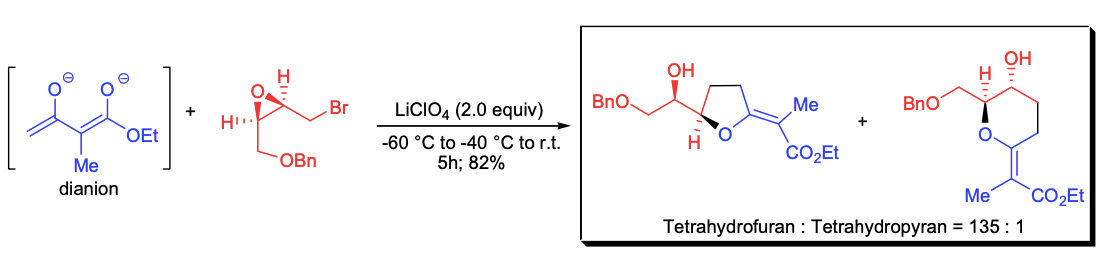
M. Nakada和合作者发展了一种合成四氢呋喃和四氢吡喃衍生物的新方法,该方法利用乙酰乙酸乙酯的双负离子与环氧溴丙烷衍生物发生反应。将LiClO4作为添加剂时,可选择性地生成四氢呋喃衍生物。
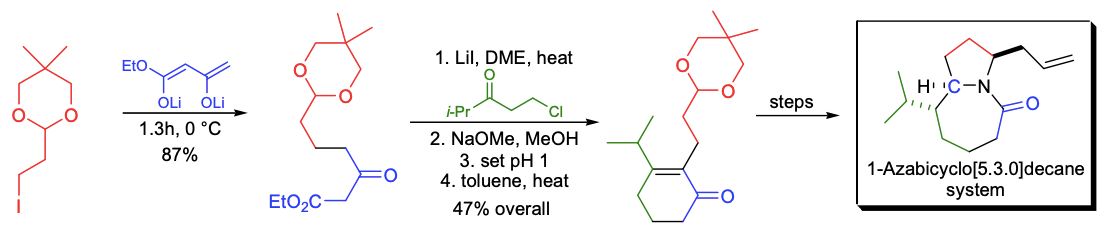
C. H. Heathcock实验室开发了一种针对Stemona生物碱典型核心骨架的合成策略。通过乙酰乙酸乙酯双负离子的连续双烷基化反应制备1-氮杂双环[5.3.0]葵烷环系的前体。
思维导图(见笔记)
本博客所有文章除特别声明外,均采用 CC BY-SA 4.0 协议 ,转载请注明出处!
